分析化学是关于研究物质的组成、含量、结构和形态等化学信息的分析方法及理论的一门科学,是化学的一个重要分支。是鉴定物质中含有那些组分,及物质由什么组分组成,测定各种组分的相对含量,研究物质的分子结构或晶体。今天禄米实验室就从分析化学的发展历史、分析方法、几大分析方法等几个角度为各位粉丝介绍分析化学。。。
第一个重要阶段
20世纪二三十年代,利用当时物理化学中的溶液化学平衡理论,动力学理论,如沉淀的生成和共沉淀现象,指示剂作用原理,滴定曲线和终点误差,催化反应和诱导反应,缓冲作用原理大大地丰富了分析化学的内容,并使分析化学向前迈进了一步.
第二个重要阶段
20世纪40 年代以后几十年,第二次世界大战前后,物理学和电子学的发展,促进了各种仪器分析方法的发展,改变了经典分析化学以化学分析为主的局面。
原子能技术发展,半导体技术的兴起,要求分析化学能提供各种灵敏准确而快速的分析方法,如,半导体材料,有的要求纯度达99.9999999%以上,在新形势推动下,分析化学达到了迅速发展。最显著的特点是:各种仪器分析方法和分离技术的广泛应用。
第三个重要阶段
自20世纪70年代以来,以计算机应用为主要标志的信息时代的到来,促使分析化学进入第三次变革时期。
由于生命科学、环境科学、新材料科学发展的需要,基础理论及测试手段的完善,现代分析化学完全可能为各种物质提供组成、含量、结构、分布、形态等等全面的信息,使得微区分析、薄层分析、无损分析、瞬时追踪、在线监测及过程控制等过去的难题都迎刃而解。
分析化学广泛吸取了当代科学技术的最新成就,成为当代最富活力的学科之一。
分析方法的分类
1.按原理分:
化学分析:以物质的化学反应为基础的分析方法;
仪器分析:以物质的物理和物理化学性质为基础的分析方法;
光学分析方法:光谱法,非光谱法;
电化学分析法:伏安法,电导分析法等;
色谱法:液相色谱,气相色谱,毛细管电泳;
其他仪器方法:热分析;
2.按分析任务:
定性分析,定量分析,结构分析;
定量分析的操作步骤:
①取样;
②试样分解和分析试液的制备;
③分离及测定;
④分析结果的计算和评价;
3.按分析对象:
无机分析,有机分析,生物分析,环境分析等;
按试样用量及操作规模分:
常量、半微量、微量和超微量分析;
按待测成分含量分:
常量分析(>1%), 微量分析(0.01~1%), 痕量分析(<0.01%)
细说滴定分析法
(一)对化学反应的要求:
1.有确定的化学计量关系,反应按一定的反应方程式进行;
2.反应要定量进行;
3.反应速度较快;
4.容易确定滴定终点;
(二)滴定方式
1.直接滴定法;
2.间接滴定法;
如,Ca2+沉淀为CaC2O4,再用硫酸溶解,用KMnO4滴定C2O42-,间接测定Ca2+。
3.返滴定法;
如,测定CaCO3,加入过量盐酸,多余盐酸用标准氢氧化钠溶液返滴;
4.置换滴定法:络合滴定多用
(三)基准物质和标准溶液
1.基准物质:
能用于直接配制和标定标准溶液的物质。
要求:
试剂与化学组成一致;
纯度高;
稳定;
摩尔质量大;
滴定反应时无副反应。
2.标准溶液:
已知准确浓度的试剂溶液。
配制方法有直接配制和标定两种。
(四)试样的分解
1.分析方法分为干法分析(原子发射光谱的电弧激发)和湿法分析;
2.试样的分解:注意被测组分的保护
3.常用方法:溶解法和熔融法
对有机试样,灰化法和湿式消化法
(五)常用酸碱标准溶液的配制与标定
酸标准溶液:
HCl (HNO3, H2SO4)
配制:用市售HCl(12 mol·L-1),HNO3(16 mol·L-1), H2SO4(18 mol·L-1)稀释.
标定: Na2CO3或硼砂(Na2B4O7·10H2O)
碱标准溶液:
NaOH
配制:以饱和的NaOH(约19 mol·L-1),用除去CO2 的去离子水稀释;
标定: 邻苯二甲酸氢钾(KHC8H4O4)或草酸(H2C2O4·2H2O)
(六)酸碱滴定法的应用
NaOH与Na2CO3混合碱的测定;极弱酸的测定;磷的测定;氮的测定;
(七)影响滴定突跃的因素
滴定突跃pM¢:pcMsp+3.0~lgK¢MY-3.0
浓度:增大10倍,突跃增加1个pM单位(下限)
K¢MY:增大10倍,突跃增加1个pM单位(上限)
(八)准确滴定判别式
若ΔpM=±0.2, 要求:Et≤0.1%,
根据终点误差公式,可知需lgcMsp·K¢MY≥6.0
若cMsp=0.010mol·L-1时,则要求lgK¢≥8.0
多种金属离子共存:
例:
M,N存在时,分步滴定可能性的判断:
lgcMsp·K¢MY≥6.0,考虑Y的副反应aY(H)<<aY(N)
cMK'MY≈cMKMY/aY(N)≈cMKMY/cNKNY
lg cMK'MY =△lgcK
所以:△lgcK≥6,即可准确滴定M
一般来说,分步滴定中,Et = 0.3%
△lgcK≥5
如,cM=cN 则以△lgK≥5 为判据
分析化学概念对比
(一)准确度和精密度:
1.准确度:
测定结果与真值接近的程度,用误差衡量;
绝对误差:
测量值与真值间的差值,用E表示E=X-XT;
相对误差:
绝对误差占真值的百分比,用Er表示:
Er=E/XT=X-XT /XT×100%;
2.精密度:
平行测定结果相互靠近的程度,用偏差衡量。
偏差:
测量值与平均值的差值,用d表示;
①平均偏差:
各单个偏差绝对值的平均值: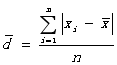
②相对平均偏差:
平均偏差与测量平均值的比值: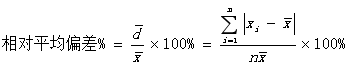
③标准偏差: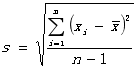
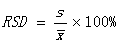
④相对标准偏差:
3.准确度与精密度的关系
精密度好是准确度好的前提;
精密度好不一定准确度高;
提高分析结果准确度方法:
选择恰当分析方法(灵敏度与准确度);
减小测量误差(误差要求与取样量);
减小偶然误差(多次测量,至少3次以上)
消除系统误差对照实验:
标准方法;
标准样品;
标准加入;
空白实验;
校准仪器;
校正分析结果;
(二)各种误差:
系统误差:
又称可测误差,具单向性、重现性、可校正特点;
方法误差:
溶解损失、终点误差-用其他方法校正;
仪器误差:
刻度不准、砝码磨损——校准(绝对、相对);
操作误差:
颜色观察;
试剂误差:
不纯-空白实验;
主观误差:
个人误差;
随机误差:
又称偶然误差,不可校正,无法避免,服从统计规律;
#不存在系统误差的情况下,测定次数越多其平均值越接近真值,一般平行测定4~6次;
- 上一篇: 实验室通风柜可能存在的安全隐患!
- 下一篇: 实验台衬托着每个孩子的科学梦



